Teorias Atômicas: Rutherford, Bohr e orbitais atômicos
Na primeira parte do resumo abordamos os modelos de Dalton e Thomson. Nesse segundo resumo vamos estudar a partir do modelo de Rutherford até o mais recente. Teoria de Rutherford No começo do século XX Ernest Rutherford realizou experimentos com o elemento radioativo polônio. Simplificadamente ele acondicionou finíssimas folhas de ouro na frente de uma […]
Resumo Teórico – Teorias Atômicas Pt.1
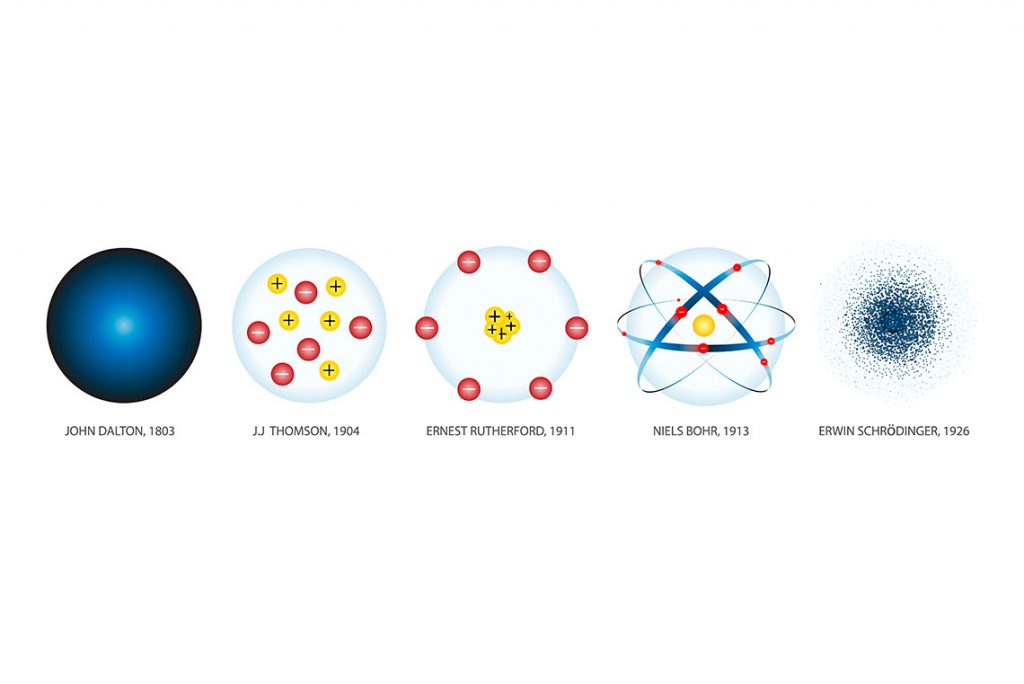
Este post é um Resumo Teórico – Teorias Atômicas Pt.1. Chamamos de teorias atômicas os modelos propostos por alguns cientistas para explicar em nível microscópico as observações realizadas em níveis macroscópicos. Sempre que uma teoria deixa de explicar satisfatoriamente fatos experimentais, outro modelo é proposto. Antes de apresentarmos a primeira teoria atômica, precisamos nos lembrar […]




