Resumo de fisica: Termodinâmica
Primeiro Princípio da Termodinâmica
AS FORMAS DE ENERGIA TERMODINÂMICA:
1. ENERGIA INTERNA DE UM GÁS: é a energia associada à temperatura e/ou agitação das partículas do gás, e a variação da energia interna de um gás depende da variação de temperatura do mesmo. Para transformações isotérmicas a temperatura não varia, a energia interna também, e a variação de energia interna é zero.
Para monoatômicos: há 3 graus de liberdade translacional, é temos que a energia interna é: ;
para gases diatômicos temos 3 graus de liberdade de translação e mais dois de rotação, logo temos que a energia interna é:
e quando quisermos a variação da energia interna, temos que: mono:
e di:
2. CALOR TROCADO PELO GÁS: é o calor cedido ou recebido pelo gás em relação ao meio externo ou fonte externa; pode ser calor sensível, com variação de temperatura, ou calor latente, com mudança de estado:
Q = mL (calor positivo para fusão e vaporização e negativo para liquefação e solidificação) ou (calor positivo para aquecimento e negativo para resfriamento).
3. TRABALHO TERMODIN MICO DE UM GÁS: é a energia trocada pelo gás que é transformada em trabalho macroscópico, isto é, expansão ou contração.
Quando o trabalho é do gás no meio externo, é expansão, o volume aumenta e o trabalho é positivo;
Quando o trabalho é do meio externo sobre o gás, é contração, o volume diminui e o trabalho é positivo. área de PxV
Princípio da Termodinâmica - Energia Cinética
A ENERGIA INTERNA DE UM GÁS MONOATÔMICO:
A colisão entre partículas de uma gás pode ser modelada como uma partícula colidindo com as paredes de um cubo de lado L. As paredes do cubo representam as outras partículas periféricas à primeira. Os choques são rápidos o bastante para serem considerados elásticos, logo, aplicando o teorema do impulso para a colisão na direção x, temos que:
,
pois a ida e volta a partícula tem velocidades com sentidos opostos. Logo temos que:
,
pois o tempo é a ida e volta, 2L pela velocidade naquela direção, logo:
,
pois F = P.A, o que nos leva a
o que nos leva a ,
pois como temos um sistema gasoso com infinitos elementos, as componentes médias da velocidade média das partículas são estatisticamente iguais, e olhando para o velocidade resultante, v, temos o teorema da equipartição de energia, que diz:
mas
, aproximadamente, logo:
logo temos que
.Ec
logo como U = Ec, energia cinética média das partículas, temos finalmente que
e a energia por partícula só depende da temperatura do gás, pois é U/n = RT.
Princípio da Termodinâmica - Teorema do Impulso e Determinação da Energia cinética de um gás
A 1ª Lei da termodinâmica é uma lei que envolve conservação de energia entre as porções energéticas trocadas por um gás em um processo termodinâmico. Podemos escrever a primeira lei assim:
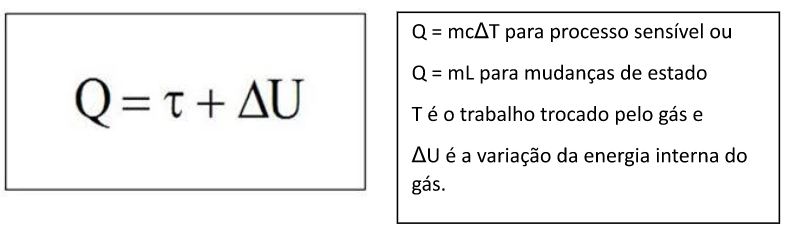
Que quer dizer: o calor trocado pelo gás (Q) pode se converter em movimento macroscópico e suas energias associadas (Τ) e/ou converter em movimento microscópico e suas energias associadas (ΔU).
O calor transforma-se em trabalho e/ou variação de energia interna, agitação das partículas.
Estudo de sinais: Se calor for positivo é calor recebido, se for negativo é perdido ou cedido; trabalho positivo significa que o gás realiza trabalho sobre o meio externo e se expande e trabalho negativo significa que o meio externo realiza trabalho sobre o gás e o gás se contrai; se a variação de energia interna é positiva ocorreu aquecimento, se for negativa, resfriamento, e, se for zero, temos transformação isotérmica, com temperatura constante.
Cálculo do calor:
Q = mcΔT para processo sensível ou Q = mL para mudanças de estado
Cálculo do trabalho trocado pelo gás:
o trabalho é numericamente igual à área do gráfico p x V, e só para a transformação isobárica torna-se
.
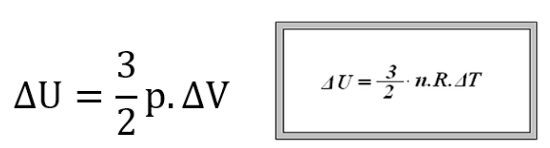
Cálculo da variação de energia interna para gases monoatômicos, com três graus de liberdade:
Princípio da Termodinâmica - Exemplos
1. ISOTÉRMICA: a temperatura é constante e a variação de energia interna, portanto é zero, o que resulta é que todo calor trocado e convertido em trabalho:
T cte logo e 1ª lei:
logo Q = T.
2. ISOVOLUMÉTRICA OU ISOCÓRICA: o volume é constante, o gás está onde sempre esteve, e o trabalho é nulo, logo, o calor é convertido em variação de agitação das partículas:
V cte logo e 1ª lei:
logo
.
3. ISOBÁRICA: a pressão externa e do gás são constantes, logo nenhuma energia é zero e parte do calor é convertido em trabalho e parte em agitação térmica:
P cte logo pela 1ª lei: .
4. ADIABÁTICA OU ISOENTRÓPICA: a entropia é constante e o gás não troca calor com meio externo, isto é, são processos rápidos de expansão com
resfriamento, ou contração com aquecimento:
S (entropia) cte logo pela 1ª lei: mas
logo .






