Resumo de quimica: Teorias Atômicas I
Chamamos de teorias atômicas os modelos propostos por alguns cientistas para explicar em nível microscópico as observações realizadas em níveis macroscópicos. Sempre que uma teoria deixa de explicar satisfatoriamente fatos experimentais, outro modelo é proposto.
Antes de apresentarmos a primeira teoria atômica, precisamos nos lembrar dos conhecimentos que se tinha na época.
A Química no passado
No final do séc. XVIII o cientista francês Antoine Laurent Lavoisier, que portava balanças mais precisas, realizou experimentos em sistemas fechados. Nestes experimentos, pode constatar que a massa total dos componentes não variava independentemente das transformações que podiam ocorrer.
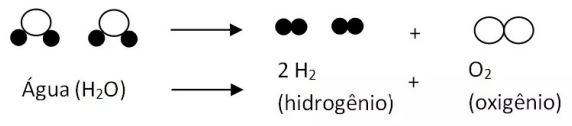
O também francês Joseph Louis Proust concluiu com as suas experiências que uma substância pura composta será formada sempre por substâncias mais simples na mesma proporção em massa. Por exemplo, Proust observou que uma amostra de água purificada, que hoje sabemos ser formada por dois átomos de hidrogênio e um de oxigênio (H2O), teria sempre a mesma proporção de 1g hidrogênio para 8g de oxigênio. Hoje calculamos isso facilmente através das massas molares dos elementos hidrogênio (1g/mol) e oxigênio (16g/mol).
Note que aqui não se tinha noção de substâncias puras, compostas, elementos ou átomos de como temos hoje. Foi com o propósito de explicar esses fatos experimentais que surgiu a primeira teoria atômica.
Teoria de Dalton
Para explicar os fatos anteriormente descritos o inglês John Dalton propôs, no início do século XIX, que:
– toda matéria é constituída por átomos e que estes são indivisíveis;
– todos os átomos de um mesmo elemento possuem propriedades iguais;
– compostos são formados pela combinação de dois ou mais átomos;
– em uma transformação ocorre um rearranjo de átomos.
Mesmo hoje em dia, que temos modelos atômicos que explicam melhor os fatos experimentais, diversas vezes lançamos mão do modelo de Dalton para explicar alguns fenômenos de forma mais simples. Ex: toda vez que usamos bolinhas para a representação de átomos estamos utilizando a teoria de Dalton.
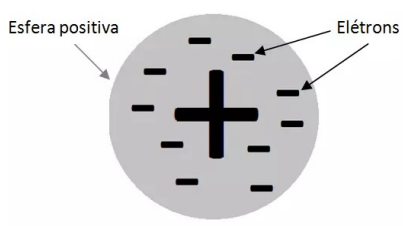
Teoria de Thomson
Depois de alguns anos, em meados do séc. XIX, diversos cientistas realizaram experimentos com o que chamamos hoje de tubo de raios catódicos. Esse tubo nada mais é que uma ampola de vidro preenchida com gás à baixa pressão. Entre as extremidades metálicas desse tubo tem-se conectada uma bateria. Ao fornecer uma diferença de potencial entre as extremidades, observa-se um raio luminoso dentro do tubo.
William Crookes incrementou esse experimento e colocou duas placas paralelas e carregadas do lado externo do tubo, criando assim um campo elétrico uniforme. Com esse aparato, Crookes observou que os raios sempre se desviavam na direção e sentido da placa que estava carregada positivamente. A conclusão foi que os raios deveriam ser formados por partículas negativas, as quais foram batizadas de elétrons. Nesse momento surgem as primeiras evidências de partículas subatômicas.
Paralelamente, Eugene Goldstein em seus experimentos com o tubo de raios catódicos também fez observações que evidenciaram a existências de uma partícula subatômica. Mas agora com carga positiva: o próton.
Observe aqui que a teoria atômica de Dalton não poderia explicar esses fenômenos, uma vez que não previa a divisão do átomo. Então o inglês Joseph John Thomson propôs outro modelo atômico, que dizia que o átomo deveria ser formado por uma esfera de carga positiva com partículas de carga negativas (elétrons) incrustados em sua superfície, garantindo assim a neutralidade elétrica do átomo. Esse modelo também é conhecido por “pudim de passas”.