Resumo de quimica: Classificação Periódica dos Elementos
Neste resumo vamos falar de um dos assuntos mais importantes para compreender a Química: a Classificação Periódica dos Elementos!
A partir do inicio do século XIX, com o crescente número de elementos químicos descobertos, cientistas de várias partes do mundo se concentravam em uma maneira de agrupar esses elementos. Eles perceberam que determinados elementos possuíam propriedades semelhantes e por esse motivo deveriam estar próximos nesse agrupamento.
Algumas sugestões foram propostas, mas foi o trabalho do russo Dimitri Ivanovitch Mendeleev que teve maior êxito.
Ele ordenou cerca de 60 elementos conhecidos na época em ordem crescente de massas atômicas(número de prótons e nêutrons) colocando na mesma coluna elementos químicos que possuíam características semelhantes.
Ele então percebeu que havia periodicidade em suas propriedades e conseguiu prever a existência de elementos que ainda não haviam sido descobertos.
No entanto, essa periodicidade não era obedecida por certos elementos que pareciam estar em “lugares errados”. Mais tarde, Henry G. J. Molesley propôs que o agrupamento fosse feito de acordo com o número atômico (número de prótons), construindo assim a tabela periódica que usamos até hoje:
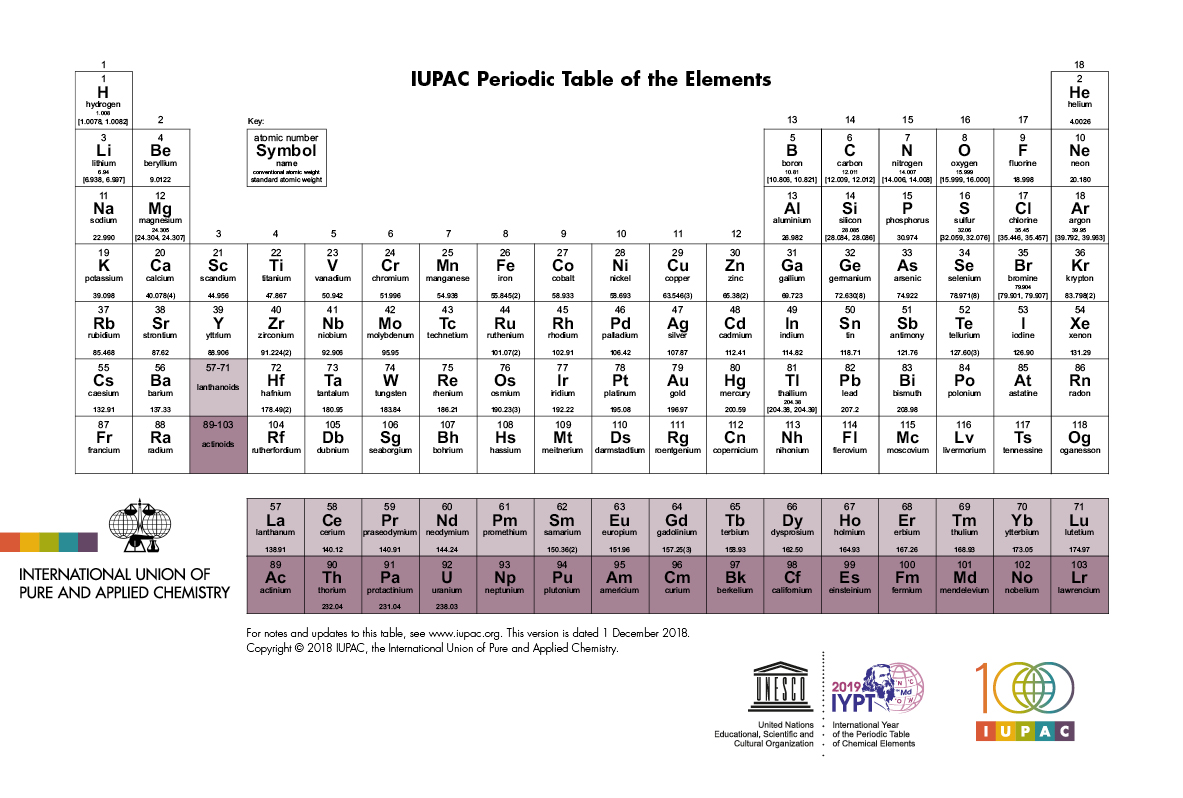
Períodos e famílias
A tabela periódica é formada por 7 linhas horizontais chamadas de períodos e 18 colunas chamadas defamílias.
Os elementos de uma mesma família possuem propriedades semelhantes, com exceção para o hidrogênio que não possui as mesmas características dos demais elementos da família 1. Algumas famílias possuem nomes específicos:
Metais alcalinos – Família 1
Metais alcalinos terrosos – Família 2
Calcogênios – Família 16
Halogênios – Família 17
Gases Nobres – Família 18.
Os elementos das famílias 1, 2, 13, 14, 15, 16, 17 e 18 possuem regularidades em suas propriedades, isso significa que elementos de uma mesma família possuem propriedades muitos semelhantes e por isso são chamados de elementos representativos.
Já as propriedades dos elementos das famílias 3 a 12 possuem exceções dentro de uma mesma família e por isso são chamados de elementos de transição. O mesmo ocorre com os lantanídeos e actinídeos que são chamados de elementos de transição interna.
Metais, não metais, semimetais e gases nobres
Os elementos também podem ser classificados em metais, não metais (ou ametais), semimetais e gases nobres:
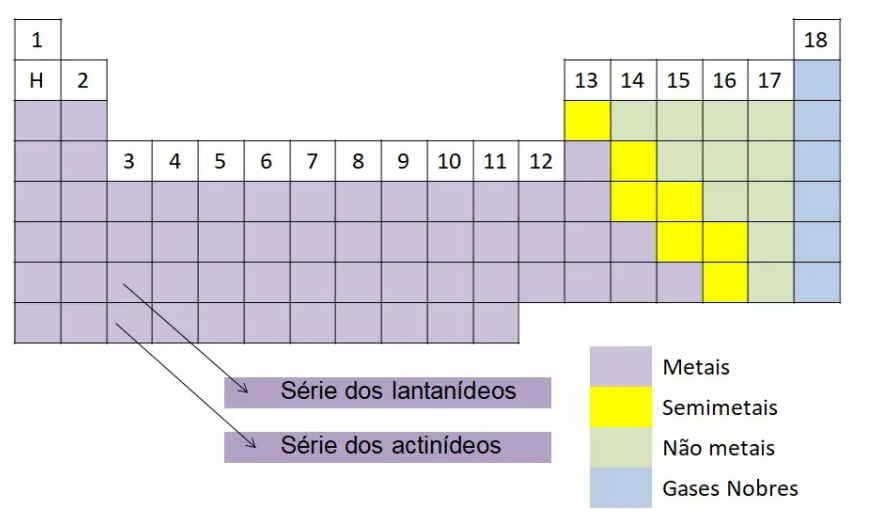
Os metais conduzem bem o calor e a eletricidade, são dúcteis (facilidade para se transformar em fios), maleáveis (facilidade para se transformar em lâminas) e são sólidos em condições ambientes, com exceção do mercúrio que é líquido.
Os não-metais são maus condutores de calor e eletricidade e não são dúcteis nem maleáveis.
Os semimetais possuem propriedades intermediárias entre os metais e não metais.
Os gases nobres são elementos encontrados isoladamente na natureza e não reagem facilmente.
Configuração eletrônica
No resumo sobre distribuição eletrônica, conhecemos o diagrama de Pauling, modo pelo qual ordenamos os elétrons de acordo com os níveis energéticos. Como em um elemento neutro o número de elétrons é igual ao número de prótons, podemos relacionar a distribuição eletrônica de um elemento com a sua posição na tabela periódica.
Assim o período de um elemento indica o numero de camadas eletrônicas ocupadas.
Exemplo:
12Mg: localizado no 3º período logo possui 3 camada ocupadas. Podemos verificar pela distribuição eletrônica: 1s2 2s2 2p6 3s2.
Em relação às famílias também podemos fazer algumas generalizações:
– Os elementos das famílias 1 e 2 (alcalinos e alcalino-terrosos) possuem os elétrons da camada de valência no subnível s;
– os elementos das famílias 3 a 12 (elementos de transição) possuem os elétrons da camada de valência no subnível d (há exceções como, por exemplo, o cromo e o cobre que possuem o subnível s semipreenchido. Configuração do cromo: [Ar]4s1d5 e do cobre [Ar] 4s1d10)
– os actinídeos e lantanídeos (elementos de transição interna) possuem os elétrons da camada de valência no subnível f (existem exceções que estão fora do escopo do Ensino Médio).
– elementos das famílias 13 a 18 possuem elétrons da camada de valência no subnível p (exceção para o Hélio que possui configuração 1s2).






