(UFPR - 2016 - 2 FASE)O ano 2016 corresponde ao an
(UFPR - 2016 - 2ª FASE)
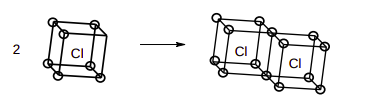
O ano 2016 corresponde ao aniversário de centenário do artigo “The Atom and the Molecule”, publicado por Gilbert N. Lewis em 1916, no qual ele propôs seu modelo de compartilhamento de pares de elétrons na ligação. Desse modelo se desenvolveram os diagramas (diagramas de Lewis) e a regra do octeto. Originalmente, Lewis denominou seu modelo de Teoria do Átomo Cúbico, em que os átomos possuiriam uma estrutura eletrônica rígida num caroço e elétrons móveis na camada de valência, que se dispõe formando um cubo. Na ligação química, os átomos compartilhariam arestas ou faces dos cubos de modo a preencher oito elétrons nos vértices de cada átomo. No esquema abaixo está ilustrado o átomo de cloro, que possui 7 elétrons (círculos nos vértices) na camada de valência. Dois átomos se unem por uma aresta para formar a molécula de Cl2, preenchendo os 8 elétrons, 1 em cada vértice de cada átomo.
a) O átomo de oxigênio possui número atômico 8. Quantos elétrons pertencem ao “caroço” e quantos estão na camada de valência?
b) Desenhe a estrutura do átomo de oxigênio segundo o modelo do átomo cúbico.
c) Desenhe a estrutura da molécula de O2 segundo o modelo do átomo cúbico. Nessa molécula, os átomos estão conectados por uma aresta ou face do cubo? Justifique.


