(UFU - 2017 - 1 FASE)Disponvel:http://zeus.qui.ufm
(UFU - 2017 - 1ª FASE)
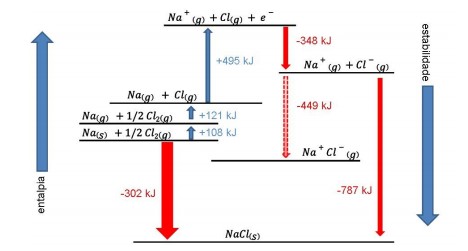
Disponível:<http://zeus.qui.ufmg.br> Acesso em: 23 abr. 2017.
A obtenção do cloreto de sódio, utilizado como sal de cozinha, pode ser analisada por meio do processo termoquímico a que está associada essa transformação. Desse modo, a partir da análise do gráfico, é possível inferir que
as reações endotérmicas associadas ao processo levam a produtos mais estáveis que seus constituintes.
a estabilidade do cloreto de sódio é maior que a dos constituintes do estado intermediário que o formam.
a formação do cloro atômico gasoso é um processo espontâneo e uma das etapas finais de obtenção do cloreto de sódio
a emissão de energia na forma de calor produz substâncias mais estáveis energeticamente que o cloreto de sódio, tais como o sódio gasoso e o gás cloro.


