(UNICAMP - 2022)Recentemente, pesquisadores desenv
(UNICAMP - 2022)
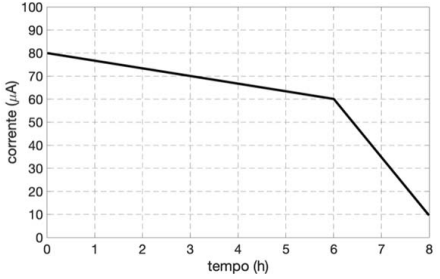
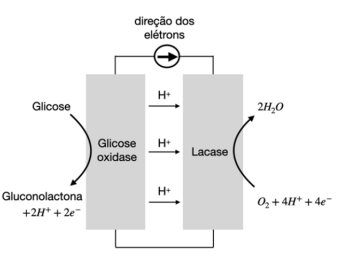
Recentemente, pesquisadores desenvolveram uma célula eletroquímica que usa glicose como combustível para gerar eletricidade (figura ao lado). Na célula usam-se enzimas adsorvidas em eletrodos de papel, onde ocorrem as reações que geram a corrente elétrica. O eletrodo da esquerda é previamente mergulhado em solução de glicose (\(20 \times 10^{-3}\) mol/L) e, depois de retirado dessa solução, a célula está pronta para funcionar. No seu funcionamento (no gráfico, no campo de resposta), observa-se uma queda da corrente ao longo do tempo, um reflexo da diminuição da concentração da glicose. Assim, para efeito de cálculo, podese considerar que a intensidade da corrente elétrica é diretamente proporcional à concentração de glicose.
a) Imagine uma situação em que esta célula eletroquímica esteja inserida diretamente na corrente sanguínea de um indivíduo saudável, cuja concentração de glicose é 90 mg/dL. No gráfico do espaço de resposta, esboce a curva da corrente em função do tempo, produzida pela célula nesta situação. Construa a curva, usando argumentos quantitativos, e justifique seu formato.
b) Com base nas informações do gráfico disposto no espaço de resposta, calcule a quantidade, em mol de glicose, que foi consumida durante as primeiras 3 horas de funcionamento.
Dado: massa molar da glicose = 180 g/mol. Constante de Faraday: 96500 C/moL (1 C = Aꞏs)