(EsPCEx - 2020)Nestes ltimos anos, os alunos da Es
(EsPCEx - 2020)
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólises com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100mL (cuba eletrolítica) coloque cerca de 50mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1molL-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25ºC e 1atm), confirme visto na figura a seguir:
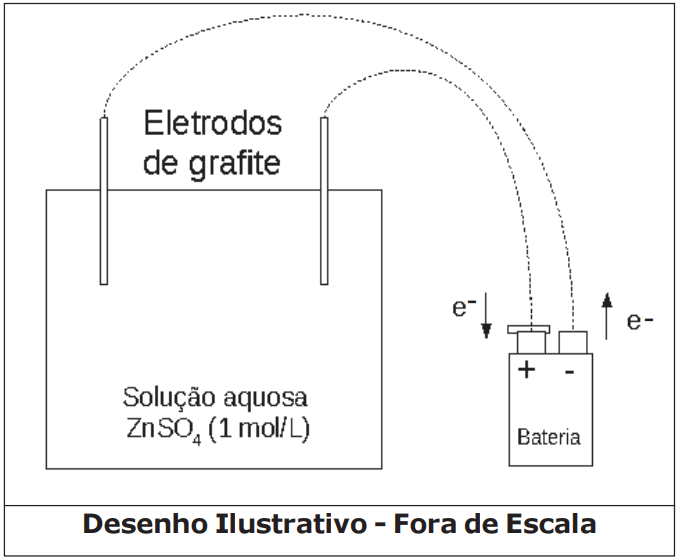
Dados: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons.
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I - Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II - A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn(s) → Zn+2(aq) + 2e-.
III - Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV - No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V - A massa de zinco metálico obtida no processo de eletrólise será de 0,83g.
Das afirmativas feitas, estão corretas apenas
I e IV.
I, III e IV.
I e V.
II e III.
III, IV e V.


