(ITA - 2000)A figura abaixo mostra como a entalpia
(ITA - 2000)
A figura abaixo mostra como a entalpia dos reagentes e dos produtos de uma reação química do tipo A (g) + B (g) →C (g) varia com a temperatura. Levando em consideração as informações fornecidas nessa figura e sabendo que a variação de entalpia (ΔH) é igual ao calor trocado pelo sistema à pressão constante, é errado afirmar que:
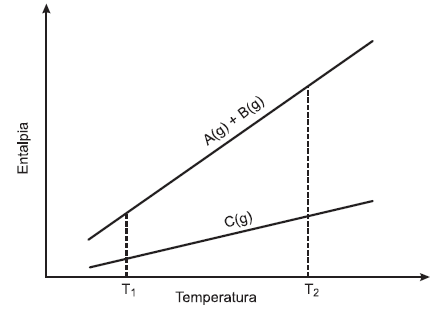
na temperatura T1, a reação ocorre com liberação de calor.
na temperatura T1, a capacidade calorífica dos reagentes é maior que a dos produtos.
no intervalo de temperatura compreendido entre T1 e T2, a reação ocorre com absorção de calor (ΔH> zero).
o ΔH, em módulo, da reação aumenta com o aumento de temperatura.
tanto a capacidade calorífica dos reagentes como a dos produtos aumentam com o aumento da temperatura.


