(FUVEST - 2002 - 2 FASE)A oxidao de ons de ferro (
(FUVEST - 2002 - 2 FASE)
A oxidação de íons de ferro (II), por peróxido de hidrogênio,
H2O2 + 2 Fe2+ + 2 H+ → 2 H2O + 2 Fe3+
foi estudada, a 25 ºC, com as seguintes concentrações iniciais:
peróxido de hidrogênio .......... 1,00 x 10-5 mol/L
íons de ferro (II) ..................... 1,00 x 10-5 mol/L
ácido clorídrico........................ 1,00 mol/L
A tabela seguinte traz as concentrações de íons de ferro (III), em função do tempo de reação.
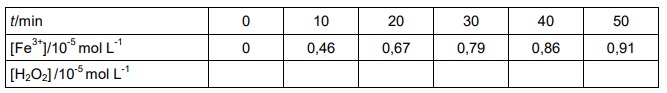
a) Use a área milimetrada da página ao lado para traçar um gráfico da concentração de íons de ferro (III), em função do tempo de reação.
b) Complete a tabela com os valores da concentração de peróxido de hidrogênio, em função do tempo de reação.
c) Use a mesma área milimetrada e a mesma origem para traçar a curva da concentração de peróxido de hidrogênio, em função do tempo de reação.



