(IME - 2021/2022 - 2 fase)Na figura abaixo, aprese
Química | Físico-Química | termodinâmica química | segunda lei da termodinâmica | energia livre de Gibbs
(IME - 2021/2022 - 2ª fase)
Na figura abaixo, apresenta-se um conjunto cilindro-pistão, onde o peso do pistão é desprezível, em que ocorre a seguinte reação do óxido de níquel (II) à temperatura constante:
\(NiO(s) + CO(s) \rightleftharpoons Ni(s) +CO_2(g)\)
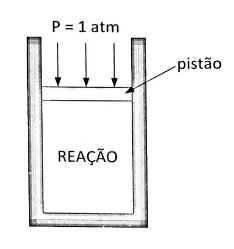
Para a manutenção da temperatura constante até a situação de equilíbrio, devem ser retirados do meio reacional 16,10 kJ de energia por mol de óxido de níquel reagido, na forma de calor. Sabe-se que a constante de equilíbrio para a reação é \(K_p = 500\) e que, na temperatura de reação, as entropias padrão são:
- \(S_0(NiO) = 38,10 J.(mol.K)^{-1}\);
- \(S_0(Ni) = 30,56 J.(mol.K)^{-1}\);
- \(S_0(CO) = 251,0 J.(mol.K)^{-1}\); e
- \(S_0(CO_2) = 296,0 J.(mol.K)^{-1}\).
Com base nas informações fornecidas e considerando que os gases se comportam idealmente, determine a temperatura na qual a reação foi conduzida.


